中和10ml浓度相同的HCL溶液和HAc溶液所需NaOH溶液的体积是否相同
来源:学生作业帮助网 编辑:作业帮 时间:2024/04/29 04:17:41
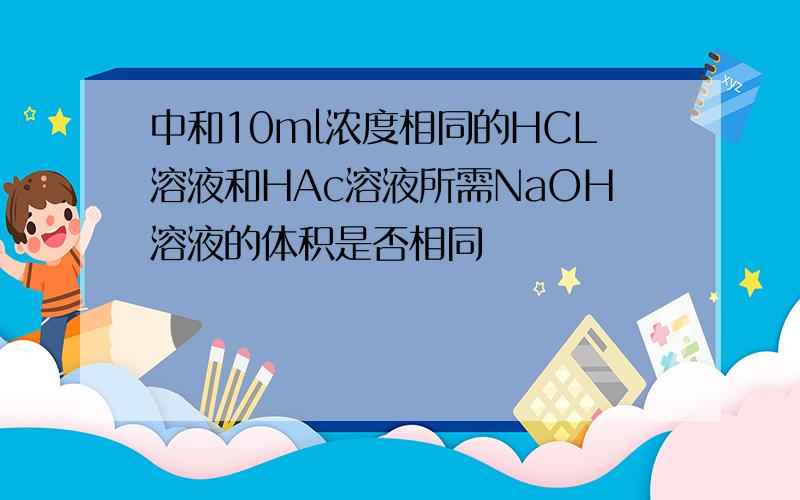
设物质的量浓度用c表示,体积用V表示(水中H+,OH-浓度忽略)摩尔质量用n表示1.因为PH=2所以,氢离子浓度为10^(-2)mol/L,氢离子摩尔质量为0.01mol/L*0.03Ln(H+水中的
你想的没错,同浓度和体积的HCL和CH3COOH溶液比较,盐酸中氢离子的浓度的确高得多,但是随着与减中和,醋酸电离出的氢离子与氢氧根离子反应了,那么导致以下化学平衡向右移动CH3COOH=H++CH3
醋酸弱酸,部分电离,盐酸是强酸,完全电离,体积相同、pH相同的HCl溶液和CH3COOH溶液,醋酸的物质的量更大,所以消耗氢氧化钠更多.故选C.
在相同PH值和相同体积的三种溶液中有:H2SO4===2H++SO42-(强酸,完全水解)HCl===H++Cl-(强酸,完全水解)CH3COOH===H++CH3COO-(弱酸,部分水解)而PH值是
因为HCI是强酸,在溶液中完全电离出氢离子,而HAC是弱酸,部分电离氢离子,所以是大于.而和强碱氢氧化钠反应,都是1比1的反应,(生成的的醋酸钠是强碱弱酸盐,)用的碱量相同.
C错,在中和碱方面强酸和弱酸(物质的量相等时)能力是等同的,弱酸中和碱时,氢氧根先和弱酸中已电离的氢离子反应,根据弱酸电离方程式,右边的氢离子减少,促进了弱酸的电离,电离出的氢离子继续和氢氧根反应~直
HCl浓度0.09mol/lNaOH浓度0.03mol/l
HCI',H2SO4,H3PO4的浓度相同吗?如果相同的话就是正确的.但是如果他们的PH是相同的话就不对了,因为H3PO4是弱酸在溶液中没有完全电离.再问:他们的物质的量浓度之比呢再答:就是说酸的物质
消耗相同物质的量浓度的NaOH溶液,体积比依次为3;2;1酸中氢离子的物质的量比为3;2;1体积相同氢离子浓度比为3;2;1HCL电离一个氢离子H2SO4电离两个氢离子H3PO4电离三个氢离子酸浓度比
等体积、等pH的H2SO4、HCl中,c(H+)相同,滴加等浓度的氢氧化钠将它们恰好中和,用去酸的体积V1=V2,但CH3COOH为弱酸,等pH时,其浓度大于HCl,滴加等浓度的氢氧化钠将它们恰好中和
为了你好懂,打个比方,盐酸像一个爽快人,身上有多少钱,用的时候,一下子就全部掏出来了【完全电离】;醋酸像一个谨慎的人,用钱时,先掏出一点【部分电离】,如果还需要,就再掏出一点【电离平衡右移】,当然如果
不相同,不相同.中和一般指使ph=7,完全反应时醋酸钠会水解显碱性,所以氢氧化钠用量少;醋酸用量多.
相同氢离子浓度的HCL和CH3COOH溶液说明两个的PH值一样的,实际上盐酸由于是强酸所以已经完全电离了,H+的浓度也就是盐酸溶质的浓度,用的氢氧化钠的量就是中和溶液里H+的量醋酸是弱酸,仅电离了一部
不同相同不同再问:答案是对的。分析一下。再答:HAc是弱酸,部分电离;酸碱中和反应,都是1:1弱酸盐要水解
不一样HAC要强因为它没有完全电离只要加入碱后它会被稀释之后就会加大电离这样它的H+的浓度就会增加
m(NaOH)=20/1000*10g=0.2gn(NaOH)=0.2/40mol=0.005moln(H2SO4)=1/2*n(NaOH)=0.0025moln(H2SO4)=c(H2SO4)*V(
分子数相同的HCL与CH3COOH即物质的量相同,HCl为强电解质H+在水中完全电离,而CH3COOH为弱电解质,在水中不能完全电离出H+,所以HCl溶液H+浓度比CH3COOH的H+浓度大,导电性H
由于全部溶解且酸有剩余,与1mlHCl反应的氧化物的质量为全部,即1.6g稀释后溶液中HCl的浓度21.02*0.1020/25=0.08576mo/L与金属氧化物反应后的盐酸量为:1mol/L*0.
(1)和金属氧化物反应的盐酸的质量=(1*0.1/20-0.02102*0.1020)*20=0.05712molMO+2HCl=MCl2+H2OX21.60.05712X=56(2)计算氧化物MO的
说明你提供的HAC是强酸呗.